文献标识码: A
DOI:10.16157/j.issn.0258-7998.2017.07.021
中文引用格式: 李生辉,卢小冬,黄成军. 高通量可寻址细胞捕获芯片控制系统的设计[J].电子技术应用,2017,43(7):81-83,87.
英文引用格式: Li Shenghui,Lu Xiaodong,Huang Chengjun. Electrical control system design for a high throughput and addressable cell capture biochip[J].Application of Electronic Technique,2017,43(7):81-83,87.
0 引言
恶性肿瘤已成为我国死亡率最高的重大疾病之一,90%以上的肿瘤病人死于肿瘤的转移和复发[1]。最新的研究表明,血液中的循环肿瘤细胞(Circulating Tumor Cells,CTCs)由于其直接来于源肿瘤组织,可以直接反应肿瘤的大小、类型等,用于多种肿瘤的疗效评价、复发及转移的监测。建立高通量、高灵敏度的CTCs检测方法,是近年来的研究热点,具有重要的科学意义和临床应用价值[2]。
当前CTCs的检测方法主要分为两大类,一类是依靠识别表达于肿瘤细胞膜表面的特异性标志物(如EpCAM、HER-2等)来实现CTCs的捕获与鉴定;另一类则是直接利用CTCs自身的物理特性(如在大小、密度、电学特性等方面)与普通细胞的差异来实现CTCs的捕获与检测。近年来,随着微流控芯片技术的发展,基于CTCs物理特性的“免标记”检测方式越来越受到重视。基于细胞介电电泳(Dielectrophoresis,DEP)原理的CTCs捕获技术,因为较高的特异性和非侵入性,受到研究者的青睐。GASCOYNE P R研究发现,不同种类的细胞,存在着一个具有较高特异性的介电电泳特征谱,可用于不同肿瘤细胞的分离[3]。基于这种介电特性,不同的研究小组设计了形式各异的介电电泳细胞捕获生物芯片,用于CTCs的分离与检测[4-5]。HUANG C设计了一种四电极系统芯片,可以实现对单个肿瘤细胞的特异性捕获、定位及细胞电裂解等多种功能[6]。但是,该种介电电泳细胞捕获芯片的每个微电极都由一路独立的电信号驱动,在有限的芯片面积上,只能实现单个或少数肿瘤细胞的检测,通量较低。
本文提出了适用于一种高通量的介电电泳细胞芯片的控制电路系统。通过该系统的控制程序和寻址电路,可以实现对具有32×32微电极单元的阵列型细胞捕获生物芯片进行微电极单元寻址、介电电泳电压信号加载、程序UI智能控制等功能,从而为高通量、可寻址的细胞捕获生物芯片的研究提供了一种解决方案。
1 细胞捕获芯片的工作机理
细胞处在非均匀电场中,由于极化效应产生介电电泳现象[7]。细胞所受的介电电泳力跟电极上所加信号的幅度、频率、电极间的距离、细胞自身的物理特性(如细胞膜电容、电导等)有关。为了利用细胞的介电电泳效应特异性的捕获肿瘤细胞,在细胞捕获芯片上加载的介电电泳信号是至关重要的。
本文所设计电路控制系统驱动的细胞捕获生物芯片如图1所示。芯片为32×32的阵列结构,共1 024个单元,每个单元由一对微电极构成。所设计的电路控制系统需要实现对该1 024个单元的寻址,并将特定幅值、相位和频率的交流信号加载到使能的微电极对上,以用于介电电泳细胞捕获[7]。

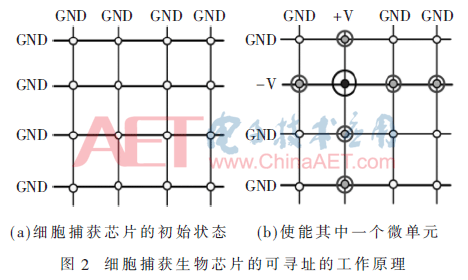
针对图1介电电泳细胞捕获生物芯片的控制电路需求,本文提出的驱动电路设计方案基于图2的工作原理,以4行×4列的微电极阵列为例,微电极阵列的所有行和列电极都接地(GND),均处于非使能状态,如图2(a)所示;当需要使能第2行、第2列微电极单元,如图2(b)所示,控制系统将第2列的电极加载正弦波,第2行的电极加载反相正弦波;而处在第2行或第2列的其他微电极单元,由于仅一个微电极加载有正弦波信号,所以产生的介电电泳力仅为第2行、第2列微电极单元的1/4[7],通过调整正弦波信号的幅度、频率,仅使第2行、第2列的微电极产生的介电电泳力高于细胞捕获的阈值,而第2行其他列(或第2列其他行)的介电电泳力均小于该阈值,从而实现对细胞捕获芯片上1 024个微电极单元的寻址功能。
2 细胞捕获生物芯片电学控制系统的设计
2.1 系统总体设计
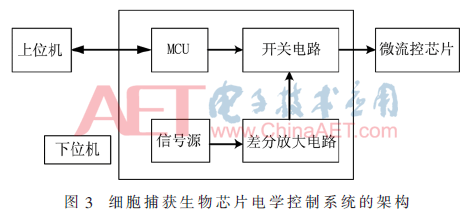
该系统包括上位机的控制程序模块和下位机的控制电路模块。下位机的控制模块又包括微控制器(MCU)控制单元、信号产生单元、开关控制单元。上位机的控制程序通过USB控制下位机,同时给下位机供电;下位机由一个微控制器来控制开关电路;差分放大电路将信号发生器产生的单路正弦波信号转换成两路相位差为π的正弦信号,再通过由MCU控制的开关电路,将两路差分信号输出给指定的微流控芯片的行电极和列电极。其系统框图如图3所示。
2.2 上位机的控制程序模块设计
由于该细胞捕获生物芯片的电学控制系统需要对64路输出通道进行控制,为了方便操作者智能、快速地操控,本文设计了基于Qt开发上位机的控制程序模块,主要通过USB实现与下位机的控制电路连接的功能。实验中,显微镜的CCD相机拍摄到微电极阵列芯片的照片后,可以在上位机控制程序中进行添加、编辑等操作,操作者可以通过上位机控制程序用户界面(UI)来观察芯片上的微电极阵列。根据不同的细胞实验需求,当需要使能特定的行和列时,在上位机控制程序UI中点击相应的行和列的按钮,即可使能该微电极单元,再次点击即可不使能该微电极单元。为了扩展功能,上位机控制程序还可以实现一键使能或不使能所有行电极和列电极,从而达到上位机智能控制的目的。
2.3 下位机控制电路模块设计
下位机控制电路模块的主要部分是微控制器(MCU)单元,它负责与上位机之间的通信,同时控制下位机中其他的电路模块。64路通道的微电极阵列芯片,其32行、32列的64个电极需要选择性加载正弦波信号,同时行电极和列电极的所加的正弦波信号的相位差为π。要对信号的选择性导通,下位机控制模块中就需要模拟开关单元;正弦波信号的差分输出就需要差分放大单元。下位机控制电路模块设计如图4所示,主要包括微控制器(MCU)单元、差分放大单元、模拟开关单元3个部分。
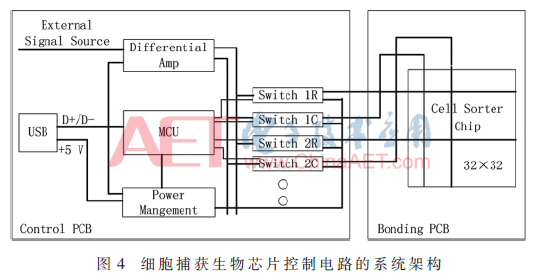
MCU选择ST的STM32F105VCT6,有80个可用的IO资源,完全满足64路输出通道的需求。差分放大芯片选择ADI高速差分放大器AD8132,它是一款低成本、差分或单端输入的差分输出放大器,通过电阻设置增益[8]。开关电路选用ADI的四路独立单刀双掷开关芯片ADG333A,具有低导通阻抗。
基于AD8132的差分放大电路的原理图如图5所示。
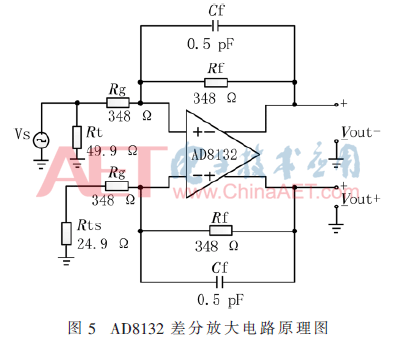
AD8132提供了两个等比反馈网路,为了匹配寄生效应,这两个网络由两个等值反馈电阻(Rf)和两个等值增益电阻(Rg)构成[7]。而且电路中,差模输出增益G=Rf/Rg,所以可以通过调整Rf和Rg的电阻比例大小来调整电路的增益,本文设计中,要求增益为1,故使Rf和Rg阻值相等。
3 系统功能测试
根据图4所示的系统架构设计了电路原理图,制备了印制电路板,并进行了元器件的焊接,然后对其电学性能进行了测试,搭建了测试平台。当需要寻址特定微电极单元时,通过操作上位机,点击相应上位机控制程序UI的行按钮和列按钮,实现对该微电极单元的使能,将正相、反相正弦电压信号加载到该微电机单元。差分放大单元的输入信号由Aligent的33621A信号发生器(输出信号最大频率可达120 MHz)产生。采用Aligent的四通道示波器MSO-X 2024A(最高频率可达200 MHz)实时观测加载到指定微电极单元的信号。
电路测试结果如图6所示,当输入信号为Vpp=2 V、频率为1 kHz的正弦波时,经本文的控制电路后,由于差分放大电路的增益G=1,此时两路单端输出信号为1 kHz、峰峰值Vpp=1 V、相位差为π两路正弦波,其中同相输出端的波形如图6(a)所示,反相输出端的波形如图6(b)所示。

当使能细胞捕获生物芯片中第2行、第2列的微电极单元后,用示波器测量加载第2行、第2列的微单元所对应下位机输出通道的信号,图7为测量波形图。

4 结论
本文设计了一款专门适用于可寻址的高通量微电极阵列型细胞捕获生物芯片的控制电路系统,能够实现对32×32个微电极单元寻址、介电电泳电压信号的选择性加载、上位机程序UI控制等功能。该系统设计结构简单,采用上位机的人机交互界面操控。该系统的研发对进一步促进细胞介电电泳技术在肿瘤细胞的早期检测方面的应用具有重要意义。
参考文献
[1] 吕晓庆,李雷,陈红梅,等.微流控芯片技术在循环肿瘤细胞分离中的研究进展[J].生物化学与生物物理进展,2015,42(4):301-312.
[2] 王英慧,王丽茹,孙巍,等.晚期非小细胞肺癌患者外周血循环肿瘤细胞检测5例并文献复习[J].中国医药指南,2014(22):269-270.
[3] GASCOYNE P R,SHIM S.Isolation of circulating tumor cells by dielectrophoresis[J].Cancers,2014,6(1):545-579.
[4] SHIM S,STEMKEHALE K,NOSHARI J,et al.Dielectro-phoresis has broad applicability to marker-free isolation of tumor cells from blood by microfluidic systems[J].Biomi-crofluidics,2013,7(1):011808.
[5] HAROUAKA R A,NISIC M,ZHENG S Y.Circulating tumor cell enrichment based on physical properties[J].Journal of the Association for Laboratory Automation,2013,18(6):455-68.
[6] HUANG C,LIU C,LOO J,et al.Single cell viability observation in cell dielectrophoretic trapping on a microchip[J].Applied Physics Letters,2014,104(1):013703.
[7] FORSHAW J R,GODDARD P,YEOMANS J.Quantum chromodynamics and the pomeron[M].Cambridge University Press.,1997.
[8] 屈翠香,李刚.低成本高速差动放大器AD8132[J].电子设计工程,2001(11):25-27.
作者信息:
李生辉1,2,3,卢小冬2,黄成军2,3
(1.中国科学院微电子研究所 健康电子研发中心,北京100029;
2.中国科学院微电子研究所 新一代通信射频芯片技术北京市重点实验室,北京100029;
3.中国科学院大学 未来技术学院,北京101400)

