文献标识码: A
DOI:10.16157/j.issn.0258-7998.171624
中文引用格式: 唐思源,苗玥,杨敏. CT影像中毛玻璃型肺结节提取方法的研究[J].电子技术应用,2018,44(2):109-114.
英文引用格式: Tang Siyuan,Miao Yue,Yang Min. GGO lung nodule extraction methods of CT images[J]. Application of Electronic Technique,2018,44(2):109-114.
0 引言
据统计,肺癌是癌症病例中发病率较高的一类癌症,但如果早期发现,可以极大地降低患者的死亡率。发现早期肺癌的主要方法是通过X射线或者CT发现病人病灶,X射线成像模糊,不易观察病灶发展。目前都采用多层螺旋CT[1]或者磁共振成像(MRI)检测肺癌,肺结节是肺癌在CT上的表现形式,通过详细地分析并精确地检测肺结节,可以提高肺癌早期诊断的准确率,并有着重要的临床价值。
在肺结节的5种类型中,国内外研究最多的是实心型结节,包括孤立型、粘连血管型、粘连肺壁型三类[2]。而空洞型及毛玻璃型结节研究方法相对比较少,毛玻璃型肺结节与实心型结节相比,没有固定的形状、大小以及清晰的边界,不易提取结节图像的特征,很难通过一种有效的方法检测并提取出肺结节。MAEKADO M[3]通过计算图像的灰度值,绘制直方图来提取毛玻璃型肺结节。KATSUMATA Y[4]用滤波器拉伸血管和结节的对比度,提取肺结节的特征,最后用神经网络分类器识别出毛玻璃型结节。ZHOU J H[5]首先用圆点滤波器(Dot filter)去掉噪声和周围血管,然后提取纹理特征,最后用K-NN分类器识别毛玻璃型结节。
文献[3]中通过滤波器增强GGO型肺结节的灰度值后,可以直接通过阈值法检测GGO型结节。但是用滤波器增强GGO型结节对比度时,由于GGO型结节边缘模糊,形态无规律,很容易漏检,再用阈值法提取GGO型结节会把血管混淆进去,从而导致检测的精确率下降。文献[5]中用圆点滤波器只提取到了圆形的肺结节,漏掉了部分非圆形肺结节。本文在分析毛玻璃型结节特点的基础上,对现有的研究方法进行改进,提出了一种检测和提取毛玻璃型结节的新方法。基于形状的滤波器能很好地提取部分具有球型形状的GGO型结节,但会漏掉一部分无规则的GGO型结节。只用阈值法,检测的准确率会下降;只用形状滤波器,检测的漏检率会提高。把二者结合起来,与单独使用阈值法或形状滤波器方法相比,降低了假阳性,提高了检测的准确率。
1 基于CT图像的肺实质分割原理
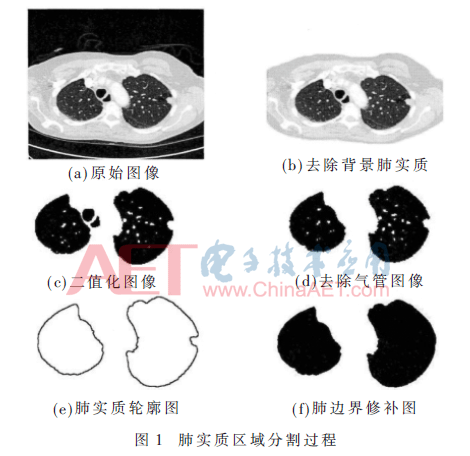
人体的组织器官是错综复杂并相互关联的,首先要从组织器官中把肺部区域分割[6]出来,去掉肺实质周围的气管、噪声等无关信息,如果有两肺部粘连情况,还要对其进行分离。应用改进的阈值法区分肺部区域和背景,如果出现左右肺粘连情况时,通过基于分水岭变换的分割方法分离左右肺区,最后对肺边界进行修补。
首先,剔除背景,绘制肺部区域及周围背景的灰度直方图,找到峰谷,获得初始分割阈值,对于背景和肺实质重叠区域,将多个峰谷应用迭代法进行修复,最终得到最佳阈值,再应用区域生长方法将背景从肺部区域中去除。其次,去掉气管,肺实质外部及肺壁上含有的气管、血管等管状结构的器官,为了精确地提取肺部区域,本文提出一种改进的3D区域生长方法[7]去除外部管状器官。如果左右肺有粘连,分离左右肺,首先定位粘连的肺部区域,然后再进行左右肺区的分割,最后再应用形态学运算调整分割误差。最后,进行肺边界的修补,在进行肺实质的初始分割后,肺边界处表现出许多凹凸不平的现象,主要是由于有一些结节在肺部内边缘或者粘连的外部区域,为了降低结节的漏检率,本文利用滚球法和形态学操作修补肺边界的缺口,将肺结节包含在肺实质中,得到平滑和完整的肺边界。滚球法的原理[8]是设定一定半径的圆形,利用边界的曲率变化,圆形模板在肺边界沿着指定方向滚动一圈,并回到初始位置,最后利用圆形模板对边界进行形态学操作的过程。
2 肺实质分割算法及结果
2.1 背景剔除
背景剔除具体算法流程为:
(1)输入影像信息,计算获得CT图像上X、Y轴方向的最大分辨率Amax、Bmax。
(2)计算初始阈值T,通过阈值把像素集分割成A、B两个区域,计算两个区域像素集的均值μa、μb,获得最佳阈值:

(3)种子点的选择,从图像最左侧出发,设定四邻域模板,扫描周围像素点,如果像素点的灰度值小于Tz,则为种子点。
(4)初始参数设定:Tz=-400 HU,Plefttop=(1,1),Prighttop=(1,Bmax),Pleftdown=(Amax,1),Prightdown=(Amax,Bmax)。
(5)设定区域生长规则:其中I(Ai,Bi)为原始图像的任意像素值,N4(Ai,Bi)是Ai、Bi的四领域像素点。

从左上到右下所有图像的所有区域,找出满足式(2)、式(3)的所有像素点。
(6)应用区域生长算法对所有种子点的四邻域像素进行搜索,直到不满足条件为止。
(7)将满足搜索条件的背景区域设置成白色,对图像进行二值化操作。
2.2 去掉气管
提取肺实质外部气管的算法思想是:设定种子点后,应用棋盘距离标记方法生成区域内的像素,确定好棋盘间的距离K,经过第N次迭代后,依据区域生长规则,搜索满足条件的所有像素点,最后设置生长终止条件,检测到气管区域。设V(K)为满足区域生长的面积值,绘制V(K)值的曲线变化图,观察曲线图中值的变化,如果数值突然变大,表明检测到管状器官,提取并去掉该区域,具体步骤如下:
(1)种子点的选择:从中肺野层片上开始搜索种子点,设定4×4模板,搜索所有满足像素点的区域,利用区域生长法获得种子点。
(2)生长规则:搜索种子点周围6领域像素的值,保留T+6与T-6之间的像素值,搜索不少于100个像素的面积区域。
(3)终止条件:计算函数V(K)的面积导数,如果面积导数值大于零,则停止搜索,提取气管区域,获得肺实质。
2.3 左右肺分离
剔除背景及气管后,有的肺部CT图像中的左右肺是粘连在一起的,能精确地分离出左右肺是检测结节的前提。具体算法过程如下所示:
(1)定位感兴趣区域:首先应用投影法[9],公式如下:

计算像素点的积分值,应用积分值确定像素点的坐标S(x0,y0)后,以坐标点为中心,确定半径R,得到一个矩形区域,该区域即为左右肺相连的区域。
(2)左右肺分割:用0和1值对待分割的矩形区域进行标记,然后计算像素的梯度幅度,求出极值,根据极值设定“分水岭”,用山脊来表示双肺区域,用山谷表示双肺间纵膈区,最后用山谷的极值来分割左右肺区。对分割的左右肺进行二值化处理及颜色的反转。
(3)腐蚀膨胀方法精确分割区域:由于左右肺连接处结构复杂、形态多样,本文应用形态学方法对内外分组区域的像素点进行调整。通过对连接部件的分析,不断调整形态学算子的初始半径r0,对矩形区域进行腐蚀和膨胀运算,直到完全并精确地分割左右肺区。
2.4 肺边界修补
滚球法的算法步骤:
(1)分别提取左右肺部区域图像,对其进行边界修复;
(2)通过大量的实验数据获得合理的圆形半径,应用圆形模板在边界滚动,修补边界的凹陷处;
(3)应用基于局部区域的滚球法提高图像处理速度,缩小形态学操作的范围,减少运行时间。
2.5 肺实质仿真分割结果
实验数据来源于美国LIDC(Lung Imaging Database Consortium)肺影像数据库,按照本文的方法对非粘连左右肺区采用的分割步骤,获得的处理结果如图1所示。
3 基于形状特征和滤波增强法的GGO型结节检测
GGO型结节的形态特征表现为模糊的稀薄影,与实心型结节相比,形状不规则、边界不清晰。但部分GGO型结节的局部结构都是类球型的,很多无规则形状的GGO型结节都是由这些类球型局部结构组成的。分析了结节的特点后,先提取球型结构的GGO型结节,然后再用滤波增强后的阈值法提取剩余结节,该方法与单独使用一种方法相比,降低了漏检率,假阳率也有所下降。
3.1 形状指数的定义
形状指数(shape Index)[10]、CT值和曲率可以表示像素的局部特征。形状指数的值表示了与球型的接近比例。大部分肺结节表现出类球型结构,而血管是类管状结构,通过形状指数数值的差异,可以区分并提取出肺结节。形状指数是由曲率以及导数运算计算得出。设K(s)、H(s)为像素s的高斯曲率值和平均曲率值,可得公式:
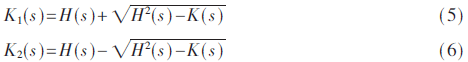
通过K1(s)、K2(s)计算得出像素s的主曲率,最后推导出形状指数的值为:

表1给出了5种形状指数值及对应的形状说明。

3.2 基于形状特征的GGO型结节的提取
目前,检测实心型肺结节常用的方法有滤波增强法、圆点滤波器法等,但对于低密度的GGO型结节,由于边界模糊,直接应用滤波增强法不能精确地检测和提取肺结节,部分GGO型结节也是由局部类球型的小肺结节组成的。因此,利用形状指数特征区分具有球型特征的GGO型结节和血管是实际可行的。
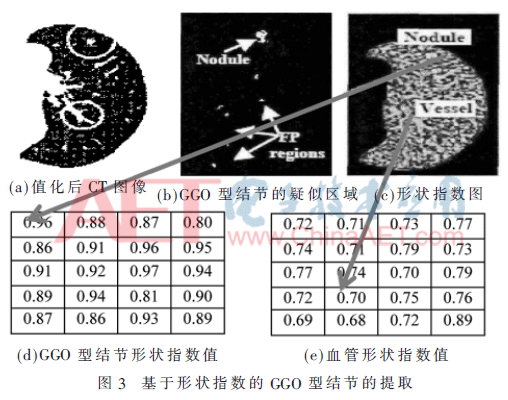
下面给出应用形状特征提取疑似GGO型结节区域的处理过程,设i、j为所选区域Rs任意像素值,Vi、Vj为接近球型的经验阈值,阈值的取值范围在0.8~1.0之间,本文设定Vi=0.91,Vj=0.88。定义SI(i)、SI(j)为像素i、j的形状指数,对应的公式有:

(1)在Rs区域内,提取满足式(8)的i像素,以及i像素周围四邻域的连通区域Rsi。
(2)在Rs区域内,提取满足式(9)的j像素,以及j像素周围八邻域的连通区域Rsj。
(3)如果Rsj区域至少包含Rsi区域内的一个连通区域,则Rsi即为疑似候选区域。
(4)定位候选区域后,应用公式:

其中,fM为Rsi区域的CT均值,通过式(10)、式(11)计算候选区域密度的最大值fTH、最小值fTL,应用自适应阈值法对Rsi区域进行分割,提取出类球型的GGO型肺结节。
在生成的形状指数图上,数值在0.8~1.0之间是类球型,0.5~0.75之间的是类管状型,通过数值可以提取出类球型的GGO型肺结节。
3.3 基于自适应非线性滤波器GGO型肺结节的提取
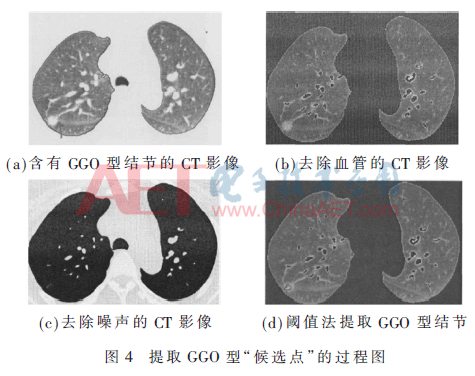
利用形状指数特征可以提取具有类球型结构的GGO型肺结节,但部分非球型结构的结节还混淆在肺实质里,为了降低漏检率,在第二阶段通过自适应非线性滤波器(Adaptive Nonlinear filter,AN filter)[11]拉伸肺实质与肺结节的对比度,去除噪声后,用阈值法提取剩余的非球型的肺结节,提取结节步骤:
(1)去除候选区域内的血管:计算候选结节区域内像素的形状指数值,由表1可知,血管的形状指数值在0.5~0.75之间,设阈值T=0.75,应用阈值法,提取阈值为0.75的像素,组成的像素集就为候选区域内的血管。
(2)剔除类球型肺结节:应用第一阶段形状指数特征检测出类球型肺结节,图像二值化后,去除该类型的结节,保留肺实质及部分非球型肺结节。
(3)应用AN filter滤波器区分肺结节:由于肺实质与肺结节的CT像素密度值比较接近,通过非线性滤波器拉伸肺实质与肺结节的对比度。设自适应滤波器模板S的大小为k1×k2,用模板系数mij表示像素(x,y)与像素(x+i,y+j)灰度值之间的相似程度,如果相似程度相似,则mij=1,否则mij=0。模板S的大小及模板系数mij的公式表达如下所示:

为了使滤波器的效果更好,把高通滤波器gH(x,y)与低通滤波器gL(x,y)相结合,card(S)表示集合S的个数,公式表示如下:

(4)去除图像噪声:利用多尺度的高斯函数去除图像的噪声,对图像进行平滑处理,设结节大小的取值范围为[r0,r1],目前检测的肺结节大小通常介于3 mm~30 mm之间,高斯函数中尺寸参数σ的值应该为[r0/3,r1/3],具体计算σ值的流程为:

(5)阈值法提取肺结节:绘制候选区域图像的灰度分布图,计算得出阈值T的值,利用估计阈值法分割并提取非球型肺结节。
4 GGO型结节特征提取原理
得到分割后的肺结节区域后,由于肺部结构的复杂,在肺结节内包含部分假阳性结节,即血管或气管及噪声等。对肺结节的特征进行定性和定量的分析,并提取结节的特征,可以更精确地区分出肺结节,提高了检测结节的准确率,也降低假阳率。目前,肺结节的特征有形状、灰度、位置等三大类。本文主要在结节的大小、外部形状、内部特征[12]等方面进行特征提取,通过对提取出的特征进行合理的排列,选择一组最佳的特征组合,放入分类器中提取并识别肺结节。具体的特征如下:
4.1 形状特征
为了反应结节的形状、大小等方面的差异性,本文计算的形状特征值有如下几个,其中I表示像素数,C1表示结节区域内接圆的面积,C0表示结节区域外接圆的面积,R是结节区域的长轴与短轴形成的矩形。
(1)面积A:

4.2 灰度特征
灰度特征统计了图像中像素点灰度值的分布情况,本文主要提取肺结节中以下几个灰度特征值,其中面积Cx表示结节包含的像素数,I(x,y)表示每个像素点的灰度值。
(1)灰度平均值Mx:

4.3 位置特征
位置特征反应肺结节在肺区域内所处的位置信息,本文主要提取中心距、中心角两个位置特征,(xp,yp)表示肺结节质心p的坐标值,(xo,yo)表示肺实质质心o的坐标值。中心距EU表示p与o的欧式距离。中心角AX表示质心p对肺实质质心o的辐角,令![]() (0≤
(0≤![]() ≤2π)为op与x轴的夹角。
≤2π)为op与x轴的夹角。
(1)中心距EU:
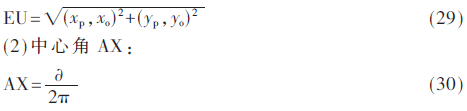
5 GGO型结节特征选择及分类算法
特征选择[13]就是从特征集中挑选能准确地区分肺结节和其他组织器官的最佳特征组合,本文应用遗传算法选择特征值,根据最佳特征组合去除错分的肺结节,把选择好的最佳特征组合值放入SVM分类器进行训练,提取出更精确的肺结节。图2给出特征选择的框架图。

最后把最佳特征组合放入SVM分类器中训练,训练的算法过程为:(1)绘制结节区域的灰度图;(2)提取结节的特征值;(3)设置特征维数I(1~9);(4)根据维数选择特征组合;(5)将组合值代入SVM分类器进行运算,得出参数值;(6)继续对训练样本进行检测,得出特征组成的检测率;(7)检测是否为最佳的特征组合,若是,则结束;(8)特征维数I=I+1,继续选择最佳特征组合,重复步骤(1)。
6 实验结果与分析
6.1 实验数据
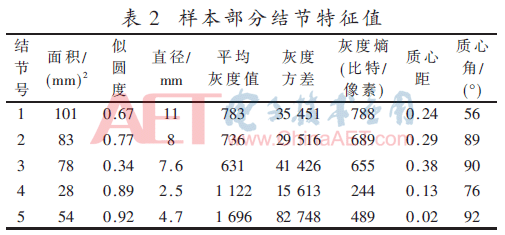
实验数据来源于LIDC(Lung Image Database Consortium)数据库,从数据库中随机选取40张病例影像CT图像。影像数据图像里共含有结节229个,经过筛查,包含粘连血管型结节有69个,孤立型结节90个,毛玻璃型结节有42个,肺壁型结节有28个,结节的直径在3 mm~30 mm之间,毛玻璃型结节是本实验要检测的结节,样本的部分结节的特征值如表2所示。
6.2 实验环境
本实验所有数据是在Windows 7、主频2 GHz、内存4 GB的计算机配置上完成的,编程软件为MATLAB2012,开发平台是在NIL库下实现的。
6.3 实验结果
图3给出了利用形状指数提取GGO型结节的过程。图4给出了利用阈值法提取剩余结节的过程,图4(d)图中黑色圈标注区域即为提取的GGO型肺结节。
对于实验数据及算法的评价,通过敏感性和特异性来评估实验结果。敏感性(Me)[14]:算法能否把金标准指定的结节全部检测出来,有多少漏检情况。特异性(Te):根据金标准,能否把不是结节的判断出来,有多少误检情况。敏感性值高,漏检的少。特异性值低,误检率低。定义TP为检测出真结节的个数,即真阳性;FN为没有检测出真结节的个数,即假阴性;TN为检测不是结节的个数,即真阴性;FP为检测出假结节的个数,即假阳性。定义公式如下所示:

根据结节的“金标准”区域,按照如下3个准则统计该算法的敏感性和特异性,共检测出42个毛玻璃型结节中的39个结节,检测的敏感性达到92.8%时,特异性达到15.6%。
去除假阳性结节后,把最佳特征组合放入分类器中,提取出肺结节,本文的算法与现有的文献[3]以及文献[5]的方法相比,结果如表3所示,该算法在性能上都有所改进。

6.4 实验分析
本文提出的分两阶段检测毛玻璃型结节的算法,从检测性能上来看,效果比现有的方法要好。应用形状指数检测GGO型结节,其中阈值的选取对结节检测的敏感性和特异性影响比较大。图5绘制了受试者工作特征(ROC)曲线图[15],以假阳性率(FPS)表示横坐标,以真阳性率(TPF)表示纵坐标。从曲线图可以得知,阈值取0.88~0.91之间,敏感性达到最大,即漏检的结节数最少。

7 结论
在分析了GGO型结节的特征后,在现有方法的基础上,提出了一种提取GGO型结节的新方法。该方法主要针对4 mm~30 mm的肺结节进行检测,首先检测类球型肺结节,再用滤波器增强的阈值法检测非球型肺结节。两个部分相结合,降低了结节的漏检率。接下来提取结节的部分特征,通过遗传算法进行特征选择。最后,根据最佳特征组合去除假阳性结节,利用SVM分类器识别出GGO型肺结节。
从LIDC数据库中下载100张CT图像来评估本文的算法,在检测敏感性达到92.8%时,特异性为15.6%,评估结果表明本文的方法能较好地提取出GGO型肺结节。
参考文献
[1] 杨瑞森.肺癌流行病学和早期诊断新技术[J].肿瘤防治杂志,2011,11(7):745-748.
[2] 贾同,魏颖,赵大哲.一种基于CT影像的肺癌病灶检测新方法[J].电子学报,2010(11):83-87.
[3] MAEKADO M,KIM H,ISHIKAWA S,et al.Automatic extraction of ground-glass opacity on lung CT images by histogram analy sis[C].International Conference on Control,Automation and Systems,2013:2352-2355.
[4] KATSUMATA Y,ITAI Y,MAEDA S.Automatic detection of GGO candidate regions employing four statistical features on thoracic MDCT image[C].International Conference on Control,Automation and system,2007.
[5] ZHOU J H,CHANG S,METAXAS D N,et al.Automatic detection and segmentation of ground glass opacity nodules[C].Medical Image Computing and Computer-Assisted Intervention MICCAI,2006,4190:784-791.
[6] 曹蕾,占杰,余晓锷,等.基于自动阈值的CT图像快速肺实质分割算法[J].计算机工程与应用,2008(12):182-185.
[7] 翟志伟.基于CT图像的肺部肿瘤检测与诊断[D].哈尔滨:哈尔滨工业大学,2015.
[8] 孙明磊.基于肺部CT图像的肺结节自动检测与识别[D].上海:华东理工大学,2012.
[9] 王青竹.基于三维SVM的肺部CT中的结节检测算法[D].长春:吉林大学,2011.
[10] 林红利.基于CT影像的肺结节病变计算机辅助诊断关键技术研究[D].长沙:中南大学,2011:76-78.
[11] ARMATO S G,ALTMAN M B,WILKIE J.Automated lung nodule classification following automated nodule detection on CT:a serial approach[J].Medical Physics,2013,30(6):1188-1197.
[12] 孙申申.基于影像的肺结节检测与分割方法研究[D].沈阳:东北大学,2009.
[13] 张立兰.基于数学形态学的组织切片细胞图像分割算法的研究[D].锦州:辽宁工业大学,2015.
[14] NAKAMURA Y,FUKANO G,TAKIZAWA H.Eigen nodule: view-based recognition of lung nodule in chest x-ray CT images using subspace method[C].Proceeding of the 17th International Conference on Pattern Recognition(ICPR'04),2004:1051-4651.
[15] 贾同,孟琭,赵大哲,等.基于CT图像的自动肺实质分割方法[J].东北大学学报(自然科学版),2008(7):55-57.

